|
|
|
 |
药店国别: |
|
| 产地国家: | 日本 |
| 处 方 药: | 是 |
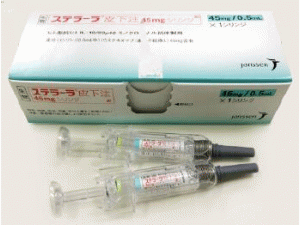
| 所属类别: | 45毫克皮下注射剂 1支×0.5毫升 |
| 包装规格: |
45毫克皮下注射剂 1支×0.5毫升 |
| 计价单位: |
套件 |
| 生产厂家中文参考译名: |
| 杨森制药 |
| 生产厂家英文名: |
| Janssen Pharmaceutical |
| 该药品相关信息网址1: |
| http://www.info.pmda.go.jp/go/pack/3999431G1025_1_06/ |
| 该药品相关信息网址2: |
|
| 该药品相关信息网址3: |
|
|
| 原产地英文商品名: |
| Stelara(ステラーラ皮下注シリンジ)45mg Subcutaneous Injection 1×0.5ml |
| 原产地英文药品名: |
| Ustekinumab(Genetical Recombination) |
| 中文参考商品译名: |
| Stelara(ステラーラ皮下注シリンジ)45毫克皮下注射剂 1支×0.5毫升 |
| 中文参考药品译名: |
| 优特克诺基因重组 |
| 曾用名: |
|
|
|



