Ofev Capsules(Nintedanib Ethanesulfonate)尼达尼布胶囊,オフェブカプセル100mg/オフェブカプセル150mg
--------------------------------------------------------------------------------
作成又は改訂年月
2015年7月作成(第1版)
日本標準商品分類番号
87399
日本標準商品分類番号等
国際誕生年月
2014年10月
薬効分類名
チロシンキナーゼ阻害剤
抗線維化剤
承認等
販売名
オフェブカプセル100mg
販売名コード
39990A7M1026
承認・許可番号
承認番号
22700AMX00693000
商標名
Ofev Capsules 100mg
薬価基準収載年月
薬価基準未収載
貯法・使用期限等
貯法
25℃を超えるところに保存しないこと
使用期限
外箱に使用期限を表示
規制区分
劇薬
処方箋医薬品注)
注)注意-医師等の処方箋により使用すること
組成
成分(1カプセル中)
有効成分・含量
ニンテダニブエタンスルホン酸塩120.4mg(ニンテダニブとして100mg)
成分(1カプセル中)
添加物
中鎖脂肪酸トリグリセリド、ハードファット、大豆レシチン、ゼラチン、グリセリン、酸化チタン、三二酸化鉄、黄色三二酸化鉄
性状
剤形
うすい橙色不透明の軟カプセル剤
内容物
あざやかな黄色の粘稠性のある懸濁液
外形
長径
約16.3mm
直径
約6.2mm
重さ
約441.96mg
識別コード
100
販売名
オフェブカプセル150mg
販売名コード
39990A7M2022
承認・許可番号
承認番号
22700AMX00694000
商標名
Ofev Capsules 150mg
薬価基準収載年月
薬価基準未収載
貯法・使用期限等
貯法
25℃を超えるところに保存しないこと
使用期限
外箱に使用期限を表示
規制区分
劇薬
処方箋医薬品注)
注)注意-医師等の処方箋により使用すること
組成
成分(1カプセル中)
有効成分・含量
ニンテダニブエタンスルホン酸塩180.6mg(ニンテダニブとして150mg)
成分(1カプセル中)
添加物
中鎖脂肪酸トリグリセリド、ハードファット、大豆レシチン、ゼラチン、グリセリン、酸化チタン、三二酸化鉄、黄色三二酸化鉄
性状
剤形
褐色不透明の軟カプセル剤
内容物
あざやかな黄色の粘稠性のある懸濁液
外形

長径
約17.6mm
直径
約7.1mm
重さ
約626.76mg
識別コード
150
一般的名称
ニンテダニブエタンスルホン酸塩製剤
警告
本剤の使用は、特発性肺線維症の治療に精通している医師のもとで行うこと。
禁忌
(次の患者には投与しないこと)
1.妊婦又は妊娠している可能性のある女性
[動物(ラット、ウサギ)を用いた生殖発生毒性試験で、催奇形性作用及び胚・胎児致死作用が認められている(「妊婦、産婦、授乳婦等への投与」の項参照)]
2.本剤の成分に対し過敏症の既往歴のある患者
効能・効果/用法・用量
効能・効果
特発性肺線維症
用法・用量
通常、成人にはニンテダニブとして1回150mgを1日2回、朝・夕食後に経口投与する。なお、患者の状態によりニンテダニブとして1回100mgの1日2回投与へ減量する。
用法・用量に関連する使用上の注意
1.
下痢、悪心、嘔吐等の副作用が認められた場合は、対症療法などの適切な処置を行ったうえ、本剤の治療が可能な状態に回復するまでの間、減量又は治療の中断を検討すること。治療の中断後再開する場合は1回100mg、1日2回から再開することを検討すること。患者の状態に応じて1回150mg、1日2回へ増量することができる。再投与又は増量する場合は慎重に投与し、投与後は患者の状態を十分に観察すること。
2.
AST又はALTが基準値上限の3倍を超えた場合は、本剤の減量又は治療の中断を行い、十分な経過観察を行うこと。治療を中断し投与を再開する場合には、AST又はALTが投与前の状態に回復した後、1回100mg、1日2回から投与することとし、患者の状態に応じて1回150mg、1日2回へ増量することができる。再投与又は増量する場合には慎重に投与し、投与後は患者の状態を十分に観察すること。[「重要な基本的注意」の項参照]
使用上の注意
慎重投与
(次の患者には慎重に投与すること)
1.
肝機能障害のある患者[肝機能障害が悪化するおそれがある。中等度(Child Pugh B)、高度(Child Pugh C)の肝機能障害のある患者では使用経験がない。(「用法・用量に関連する使用上の注意」及び「重要な基本的注意」の項参照)]
2.
血栓塞栓症の既往歴及びその素因のある患者[血栓塞栓事象の発現を助長する可能性がある。]
3.
出血性素因のある患者、抗凝固剤治療を行っている患者[出血リスクを助長する可能性がある。]
重要な基本的注意
1.
AST(GOT)、ALT(GPT)、ビリルビン等の上昇を伴う肝機能障害があらわれることがあるので、本剤投与開始前及び投与中は定期的に検査を行い、患者の状態を十分に観察すること。肝機能障害のある患者に投与する場合は、肝機能検査をより頻回に行うなど、慎重に患者の状態を観察すること。
2.
創傷治癒を遅らせる可能性があるので、手術時は投与を中断することが望ましい。手術後の投与再開は患者の状態に応じて判断すること。
相互作用
本剤に関わる主要な代謝反応はエステラーゼによる加水分解であり、加水分解産物はその後グルクロン酸抱合酵素(UGT)によりグルクロン酸抱合体に代謝される。また、本剤はP-糖蛋白の基質である。
[「薬物動態」の項参照]
併用注意
(併用に注意すること)
薬剤名等
P-糖蛋白阻害剤(エリスロマイシン、シクロスポリン等)
臨床症状・措置方法
ケトコナゾールとの併用によりニンテダニブのAUCが約1.6倍、Cmaxが約1.8倍に上昇した。
P-糖蛋白阻害剤との併用時は観察を十分に行い、異常が認められた場合は投与の中断、減量又は中止等の適切な処置を行うこと。
[「薬物動態」の項参照]
機序・危険因子
本剤はP-糖蛋白の基質であり、P-糖蛋白の阻害により本剤の曝露が上昇する可能性がある。
薬剤名等
P-糖蛋白誘導剤(リファンピシン、カルバマゼピン、フェニトイン、セイヨウオトギリソウ(St. John’s Wort、 セント・ジョーンズ・ワート)含有食品等)
臨床症状・措置方法
リファンピシンとの併用によりニンテダニブのAUCが約50%、Cmaxが約60%まで減少した。
P-糖蛋白誘導剤との併用により、本剤の作用が減弱する可能性がある。P-糖蛋白誘導作用のない又は少ない薬剤の選択を検討すること。
[「薬物動態」の項参照]
機序・危険因子
本剤はP-糖蛋白の基質であり、P-糖蛋白の誘導により本剤の曝露が低下する可能性がある。
副作用
副作用等発現状況の概要
本剤の臨床試験は1529例の特発性肺線維症患者を対象に実施された。
第III相国際共同試験の2試験(試験1199.32及び試験1199.34)は1061例を対象に実施され、638例に本剤が投与された。これらの2試験は、本剤150mgの1日2回投与で52週間の無作為化、二重盲検のプラセボ対照により実施された。試験全体での主な副作用は、下痢342例(53.6%)、悪心122例(19.1%)、肝酵素上昇67例(10.5%)及び腹痛65例(10.2%)であった。日本人126例中76例に本剤が投与され、主な副作用は、下痢51例(67.1%)、肝酵素上昇21例(27.6%)、食欲減退11例(14.5%)、悪心9例(11.8%)であった。(承認申請時)
重大な副作用
1.重度の下痢(3.3%※1)
重度の下痢があらわれることがある。下痢症状がみられる場合は速やかに補液やロペラミド等の止瀉剤投与を行い、本剤による治療の中断を検討すること。これらの対症療法にもかかわらず持続するような重度の下痢の場合は、本剤による治療を中止し、再投与は行わないこと[「用法・用量に関連する使用上の注意」の項参照]。
2.肝機能障害(0.9%※1)
肝機能障害があらわれることがあるので、定期的に肝機能検査を実施し観察を十分に行い、異常が認められた場合には減量又は投与を中断し、適切な処置を実施すること[「用法・用量に関連する使用上の注意」及び「重要な基本的注意」の項参照]。
3.血栓塞栓症(静脈血栓塞栓:頻度不明、動脈血栓塞栓:0.5%※1)
血栓塞栓事象があらわれることがある。血栓塞栓症の徴候がみられる場合は本剤による治療の中断を検討し、適切な処置を行うこと。
4.消化管穿孔(0.2%※1)
消化管穿孔があらわれることがあるので、観察を十分に行い、異常が認められた場合には、内視鏡、腹部X線、CT等の必要な検査を行い、本剤の投与を中止するなど、適切な処置を行うこと。
5.間質性肺炎(頻度不明)
本剤の癌を対象とした臨床試験で間質性肺炎がみられており、胸部画像検査や呼吸機能検査で急激な悪化等の薬剤性の間質性肺炎の徴候がみられる場合は、本剤の投与を中止し、適切な処置を行うこと。
※1:特発性肺線維症を対象とする第III相国際共同試験(試験1199.32及び試験1199.34)の全体集団の発現率に基づく。
その他の副作用
代謝及び栄養障害
10%以上
食欲減退(14.5%)
代謝及び栄養障害
5%以上10%未満
体重減少
血管障害
5%未満
高血圧
胃腸障害
10%以上
下痢(67.1%)、悪心 (11.8%)
胃腸障害
5%以上10%未満
腹痛
胃腸障害
5%未満
嘔吐、便秘
肝胆道系障害
10%以上
肝酵素上昇(AST、ALT、ALP、γ-GTP上昇等)(27.6%)
肝胆道系障害
5%未満
高ビリルビン血症
皮膚及び皮下組織障害
5%未満
発疹
神経障害
5%未満
頭痛
その他
5%未満
出血
以上のような副作用があらわれた場合には、必要に応じて減量又は治療の中断を行うなど適切な処置を行うこと。※2
※2:特発性肺線維症を対象とする第III相国際共同試験(試験1199.32及び試験1199.34)の日本人部分集団の発現率に基づく。
高齢者への投与
高齢者では一般に生理機能が低下しているため慎重に投与すること。
妊婦、産婦、授乳婦等への投与
1.
妊婦又は妊娠している可能性のある女性には投与しないこと。[動物(ラット、ウサギ)を用いた生殖発生毒性試験で催奇形性作用及び胚・胎児致死作用が認められている。]
2.
妊娠可能な女性は本剤の投与中及び投与終了の少なくとも3カ月後までは適切な避妊措置をとること。
3.
授乳中の女性には本剤投与中は授乳を避けさせること。[動物実験(ラット)で乳汁中への移行が認められている。]
小児等への投与
低出生体重児、新生児、乳児、幼児又は小児における本剤の安全性、有効性は確立していない。[使用経験がない。]
適用上の注意
1.
服薬を忘れた場合は、次の服薬スケジュール(朝又は夕方)から推奨用量で再開すること。本剤の1日最大用量300mgを超えて服薬しないこと。
2.
カプセルは噛まずにコップ一杯の水とともに服薬すること。
薬剤交付時
3.
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。[PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔を起こして縦隔洞炎等の重篤な合併症を併発することが報告されている。]
4.
本剤は吸湿性があるので、服用直前にPTPシートから取り出すよう指導すること。また、アルミピロー包装注)のまま調剤を行うことが望ましい。
注)1アルミピロー包装中に28カプセル(14カプセル入りPTPシート×2)を含む。
その他の注意
1.
本剤との因果関係は明確ではないが、本剤の癌を対象とした臨床試験において顎骨壊死が認められている。また、類薬[血管内皮増殖因子受容体(VEGFR)阻害剤]において、投与後に顎骨壊死が発現したとの報告があり、多くはビスホスホネート系製剤を投与中又は投与経験のある患者であった。
2.
反復投与毒性試験で、ラットでは出血及び壊死を伴う切歯の破折が認められ、ラット及びサルでは、成長中の骨で骨端成長板の肥厚が認められた。
薬物動態
1.血中濃度
(1)血中濃度(日本人データ)1)
日本人の特発性肺線維症患者にニンテダニブ150mg及び100mgを食後に1日2回経口投与(初回及び最終投与時は1日1回投与)した試験で得られたニンテダニブの血漿中濃度推移を図1に、薬物動態パラメータを下記に示す。ニンテダニブの血漿中濃度は投与7日目までに定常状態に達した。
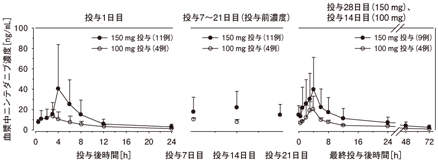
&enter;図1 日本人の特発性肺線維症患者にニンテダニブ150mg及び100mgを食後に経口投与した試験での血漿中濃度(算術平均+標準偏差)
日本人の特発性肺線維症患者にニンテダニブ150mg及び100mgを食後に経口投与した試験での薬物動態パラメータ初回投与後
パラメータ名[単位]:AUC0-12[ng・h/mL]
150mg 11例:152(60.6)
100mg 4例:59.0(67.2)
初回投与後
パラメータ名[単位]:Cmax[ng/mL]
150mg 11例:34.9(62.8)
100mg 4例:13.2(66.9)
初回投与後
パラメータ名[単位]:tmax[h]
150mg 11例:3.90(1.00-6.00)
100mg 4例:4.48(1.97-12.0)
最終投与時
パラメータ名[単位]:AUCτ,ss[ng・h/mL]
150mg 9例:218(58.3)
100mg 4例:115(32.4)
最終投与時
パラメータ名[単位]:Cmax,ss[ng/mL]
150mg 9例:39.7(68.1)
100mg 4例:20.0(64.5)
最終投与時
パラメータ名[単位]:tmax,ss[h]
150mg 9例:3.87(1.00-3.97)
100mg 4例:3.42(2.00-4.07)
幾何平均(幾何変動係数%)、tmax(,ss)は中央値(最小値-最大値)
(2)食事の影響(外国人データ)2)
健康成人にニンテダニブ150mgを空腹時及び食後に単回経口投与したときの薬物動態パラメータは、下記のとおりであった。
健康成人にニンテダニブ150mgを空腹時及び食後に単回経口投与時の薬物動態パラメータパラメータ名[単位]:AUC0-∞[ng・h/mL]
空腹時 14例:98.4(33.0)注)
食後 15例:119(53.9)
パラメータ名[単位]:Cmax[ng/mL]
空腹時 14例:11.1(60.3)
食後 15例:13.2(61.6)
パラメータ名[単位]:tmax[h]
空腹時 14例:2.00(1.48-3.98)
食後 15例:3.98(1.50-6.05)
幾何平均(幾何変動係数%)、tmaxは中央値(最小値-最大値)
注)11例
2.吸収(外国人データ)3)
健康成人にニンテダニブ100mgを食後に単回経口投与及び6mgを静脈内単回投与した結果から、絶対バイオアベイラビリティは4.69%であった。
3.分布
(1)
(外国人データ)健康成人にニンテダニブ6mgを静脈内単回投与時の定常状態での分布容積は1050Lであった。3)
(2)
(in vitroデータ)14C-ニンテダニブのヒト血漿蛋白結合率は97.8%であり、ヒト血液/血漿の濃度比は0.869であった。4)
4.代謝
(in vitroデータ)ヒト肝ミクロソームを用いてニンテダニブの代謝を評価した結果、主要な代謝反応はエステラーゼによる加水分解であった。5)加水分解産物であるBIBF 1202はさらにUGT1A1、1A7、1A8及び1A10によりBIBF 1202グルクロン酸抱合体に代謝された。6,7)
5.排泄
(1)
(外国人データ)健康成人にニンテダニブ6mgを静脈内単回投与時の全身クリアランスは1390mL/minであった。未変化体の尿中排泄率は、100mg経口投与後及び6mg静脈内投与後でそれぞれ投与量の0.05%及び1.4%であった。3)
(2)
(外国人データ)健康成人に14C-ニンテダニブ100mg溶液を単回経口投与したとき、投与放射能の0.649%が尿中に、93.4%が糞中に排泄された。8)
6.高齢者(日本人及び外国人の併合データ)9)
特発性肺線維症患者での母集団薬物動態解析の結果、年齢が66歳(解析対象集団の中央値)の場合に比べてAUCτは79歳では13%高くなり、52歳では14%低くなると予測された。
7.薬物間相互作用
(1)ケトコナゾールとの併用(外国人データ)10)
健康成人(31例)にケトコナゾール(P-糖蛋白阻害剤)400mgを1日1回3日間反復投与し、ケトコナゾール投与開始後3日目にニンテダニブ50mgを単回併用投与した場合、ニンテダニブのAUC0-∞は60.5%、Cmaxは79.6%上昇した。
(2)リファンピシンとの併用(外国人データ)11)
健康成人(26例)にリファンピシン(P-糖蛋白誘導剤)600mgを1日1回7日間反復投与し、リファンピシン投与開始後8日目にニンテダニブ150mgを単回投与した場合、ニンテダニブのAUC0-∞は50.1%、Cmaxは59.8%まで低下した。
(3)ピルフェニドンとの併用(日本人データ)1)
日本人の特発性肺線維症患者20例にピルフェニドンの併用/非併用下で本剤150mgを1日2回、28日間投与し、本剤及びピルフェニドンの薬物動態への影響を、それぞれ並行群間及び個体内比較で検討した。本剤をピルフェニドンと併用した場合、非併用時に比べて本剤の曝露が低くなる傾向がみられた(並行群間比較)。一方でピルフェニドンの曝露に本剤による明らかな影響は認められなかった(個体内比較)。
臨床成績
国際共同試験
特発性肺線維症患者513例(日本人55例)及び548例(日本人71例)を対象としたプラセボ対照無作為化二重盲検並行群間比較試験において、ニンテダニブ150mg又はプラセボを1日2回、52週間経口投与した結果、主要評価項目である投与52週までの努力肺活量(FVC)の年間減少率(mL/年)は下記のとおりであり、ニンテダニブ群とプラセボ群との比較において、統計学的に有意な差が認められた(試験1199.32及び試験1199.34)12,13)。ベースラインからのFVCの平均絶対変化量の推移を図2に示す。
FVCの年間減少率(mL/年)(試験1199.32、試験1199.34)試験1199.32
全体集団:ベースライン(mL)
本剤群:2756.8±735.1(309)
プラセボ群:2844.5±820.1(204)
試験1199.34
全体集団:ベースライン(mL)
本剤群:2672.8±776.0(329)
プラセボ群:2619.0±787.3(219)
試験1199.32
全体集団:投与52週時(mL)
本剤群:2669.0±772.0(250)
プラセボ群:2664.4±834.0(165)
試験1199.34
全体集団:投与52週時(mL)
本剤群:2637.3±811.8(269)
プラセボ群:2512.5±821.4(180)
試験1199.32
全体集団:変化量(mL)
本剤群:-90.9±242.7(250)
プラセボ群:-201.8±305.9(165)
試験1199.34
全体集団:変化量(mL)
本剤群:-86.9±283.4(269)
プラセボ群:-204.0±280.5(180)
試験1199.32
全体集団:FVCの年間減少率[95%信頼区間]a)
本剤群:-114.7[-144.8、-84.5](309)
プラセボ群:-239.9[-276.7、-203.1](204)
試験1199.34
全体集団:FVCの年間減少率[95%信頼区間]a)
本剤群:-113.6[-144.5、-82.7](329)
プラセボ群:-207.3[-245.3、-169.4](219)
試験1199.32
全体集団:プラセボ群との差[95%信頼区間]a)p値a)
本剤群:125.3[77.7、172.8]p<0.0001
試験1199.34
全体集団:プラセボ群との差[95%信頼区間]a)p値a)
本剤群:93.7[44.8、142.7]p=0.0002
試験1199.32
日本人部分集団:ベースライン(mL)
本剤群:2333.1±629.6(35)
プラセボ群:2825.5±568.9(20)
試験1199.34
日本人部分集団:ベースライン(mL)
本剤群:2497.1±705.2(41)
プラセボ群:2273.8±768.2(30)
試験1199.32
日本人部分集団:投与52週時(mL)
本剤群:2334.5±678.7(26)
プラセボ群:2698.5±683.5(17)
試験1199.34
日本人部分集団:投与52週時(mL)
本剤群:2378.3±742.3(38)
プラセボ群:2134.7±797.4(25)
試験1199.32
日本人部分集団:変化量(mL)
本剤群:-99.7±191.0(26)
プラセボ群:-222.8±284.8(17)
試験1199.34
日本人部分集団:変化量(mL)
本剤群:-104.9±232.0(38)
プラセボ群:-229.8±164.6(25)
試験1199.32
日本人部分集団:FVCの年間減少率[95%信頼区間]a)
本剤群:-142.2[-234.6、-49.8](35)
プラセボ群:-282.8[-395.7、-169.9](20)
試験1199.34
日本人部分集団:FVCの年間減少率[95%信頼区間]a)
本剤群:-137.6[-226.2、-49.0](41)
プラセボ群:-254.0[-359.4、-148.7](30)
試験1199.32
日本人部分集団:プラセボ群との差[95%信頼区間]a)
本剤群:140.6[-6.1、287.4]
試験1199.34
日本人部分集団:プラセボ群との差[95%信頼区間]a)
本剤群:116.4[-23.2、256.1]
平均値±標準偏差(例数)
a)投与群、性別、年齢及び身長を固定効果、切片及び時期(数値変数)を変量効果とした線形混合効果モデル
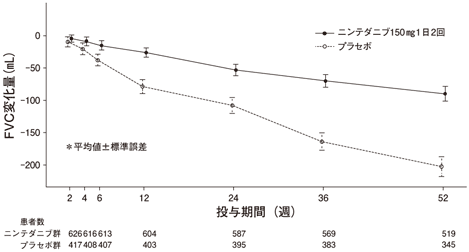
&enter;図2 ベースラインからのFVCの平均絶対変化量の推移(試験1199.32及び試験1199.34の併合データ)
薬効薬理
1.作用機序14)
本剤は、血小板由来増殖因子受容体(PDGFR)α、β及び線維芽細胞増殖因子受容体(FGFR)1、2、3及びVEGFRの各受容体においてアデノシン5'-三リン酸(ATP)結合ポケットを占拠する低分子チロシンキナーゼ阻害剤であり、特発性肺線維症の病態に関与する線維芽細胞の増殖、遊走及び形質転換に関わるシグナル伝達を阻害する。
2.抗線維化及び抗炎症作用
本剤は、in vitro試験において、PDGF、FGF及びVEGF刺激によって誘導される患者由来肺線維芽細胞の増殖及び遊走、TGF-β2によって誘導される線維芽細胞の形質転換を抑制した。15,16)また本剤は、ブレオマイシン誘発肺線維症モデル及びシリカ誘発肺線維症モデルを用いたin vivo試験において抗線維化及び抗炎症効果を示した。17~20)
有効成分に関する理化学的知見
一般名
ニンテダニブエタンスルホン酸塩(JAN)
Nintedanib Ethanesulfonate(JAN)
化学名
Methyl(3Z)-3-[({4-[N-methyl-2-(4-methylpiperazin-1-yl)acetamido]phenyl}amino)(phenyl)methylidene]-2-oxo-2,3-dihydro-1H-indole-6-carboxylate monoethanesulfonate
化学構造式
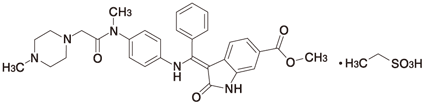
分子式
C31H33N5O4・C2H6O3S
分子量
649.76
性状
あざやかな黄色の粉末
融点
305±5℃
分配係数
log D=3.0(pH7.4)
承認条件
1.
医薬品リスク管理計画を策定の上、適切に実施すること。
2.
国内での治験症例が限られていることから、製造販売後、一定数の症例に係るデータが集積されるまでの間は、全症例を対象に使用成績調査を実施することにより、本剤使用患者の背景情報を把握するとともに、本剤の安全性及び有効性に関するデータを早期に収集し、本剤の適正使用に必要な措置を講じること。
包装
オフェブカプセル100mg:28カプセル(14×2)PTP
オフェブカプセル150mg:28カプセル(14×2)PTP
主要文献及び文献請求先
主要文献
1)
藤本剛ほか:社内資料 日本人患者での安全性及び薬物動態試験
2)
Rathgen K. et al.:社内資料 食事の影響試験
3)
Rathgen K. et al.:社内資料 絶対バイオアベイラビリティ試験
4)
Sauer A. et al.:社内資料 非臨床薬物動態試験(血漿蛋白結合)
5)
Ludwig-Schwellinger E. et al.:社内資料 非臨床薬物動態試験(代謝)
6)
Ebner T. et al.:社内資料 非臨床薬物動態試験(肝代謝)
7)
Ebner T. et al.:社内資料 非臨床薬物動態試験(小腸代謝)
8)
Rathgen K. et al.:社内資料 マスバランス試験
9)
Schmid U. et al.:社内資料 特発性肺線維症患者における母集団薬物動態解析
10)
Rose P. et al.:社内資料 ケトコナゾールとの薬物相互作用試験
11)
Jungnik A. et al.:社内資料 リファンピシンとの薬物相互作用試験
12)
Brun M. et al.:社内資料 第III相国際共同試験(試験1199.32)
13)
Brun M. et al.:社内資料 第III相国際共同試験(試験1199.34)
14)
Hilberg F. et al.:Cancer Res.68:4774, 2008
15)
Hostettler K. et al.:社内資料 薬効薬理試験(肺線維芽細胞に対する作用)
16)
Park J. et al.:社内資料 薬効薬理試験(線維芽細胞の形質転換に対する作用)
17)
Wollin SL. et al.:社内資料 薬効薬理試験(シリカ誘発肺線維症モデルマウスにおける作用)
18)
Ryffel B. et al.:社内資料 薬効薬理試験(ブレオマイシン誘発肺線維症モデルマウスにおける作用)
19)
Park J. et al.:社内資料 薬効薬理試験(ブレオマイシン誘発肺線維症モデルラットにおける予防的作用)
20)
Park J. et al.:社内資料 薬効薬理試験(ブレオマイシン誘発肺線維症モデルラットにおける治療的作用)
文献請求先
主要文献に記載の社内資料につきましても下記にご請求ください。
日本ベーリンガーインゲルハイム株式会社
DIセンター
〒141-6017 東京都品川区大崎2丁目1番1号 ThinkPark Tower
フリーダイヤル:0120-189-779
(受付時間)9:00~18:00
(土・日・祝日・弊社休業日を除く)
長期投与医薬品に関する情報
本剤は新医薬品であるため、厚生労働省告示第107号(平成18年3月6日付)に基づき、薬価基準への収載の日の属する月の翌月の初日から起算して1年を経過するまで1回14日分を超える投薬は認められていません。
製造販売業者等の氏名又は名称及び住所
製造販売
日本ベーリンガーインゲルハイム株式会社
東京都品川区大崎2丁目1番1号OFEV(尼达尼布)被纳入特发性肺纤维化国际治疗新指南
-新指南建议使用OFEV®(尼达尼布 )治疗特发性肺纤维化
-这项建议高度评价了OFEV®治疗患者的重要结果的潜在获益,包括根据用力肺活量(FVC)下降速率评估的疾病进展及死亡率
德国殷格翰2015年7月22日电 /美通社/ -- 勃林格殷格翰欢迎2015 ATS/ERS/JRS/ALAT特发性肺纤维化诊治国际循证指南(更新2011年指南)的发布,新指南建议临床医生使用OFEV®(尼达尼布)治疗特发性肺纤维化患者。
委员会高度评价了OFEV®治疗患者的重要结果的潜在获益,包括根据用力肺活量(FVC)下降速率评估的疾病进展和死亡率。建议综合考虑预期治疗费用及潜在的重要不良反应。但是建议指出,OFEV®不会增加严重不良事件,很少患者因不良反应而中止使用研究药物。
英国伦敦皇家布朗普顿医院(Royal Brompton Hospital)呼吸内科顾问医生Dr Toby Maher评论说:“这些指南很重要,为医生改善这种破坏性极大的疾病,特发性肺纤维化的诊治提供了宝贵推荐意见。此外,这些新指南还明确强调了OFEV®治疗特发性肺纤维化的作用。”
勃林格殷格翰首席医学官Dr Christopher Corsico评论说:“国际指南纳入OFEV®治疗特发性肺纤维化是改善患者治疗的一次重要进步。直到最近,才有建议提出,有获批治疗可供选择。OFEV®使用方便,每日2次就可延缓范围广泛的多种特发性肺纤维化患者**的疾病进展,减少肺功能年下降率50%。”
委员会分析了自2011年官方指南发布后收集的证据,并据此更新了治疗建议。 OFEV® 已开展两项重复性Ⅲ期试验(INPULSIS®-1和INPULSIS®-2),共有24个国家的1000多位患者参加研究,另外还进行过一项包括432位患者的II期试验(TOMORROW)。
指南联合委员会由国际领头呼吸学会的组织代表组成,包括美国胸科学会(American Thoracic Society,ATS)、欧洲呼吸学会(European Respiratory Society,ERS)、日本呼吸学会(Japanese Respiratory Society,JRS)和拉丁美洲胸科学会 (American Thoracic Association,ALAT)。
OFEV®的临床数据
INPULSIS®临床试验显示,OFEV®可持续稳定降低FVC年下降率,肺功能年下降率降低50%。 OFEV®是唯一能够显著降低裁定的特发性肺纤维化急性加重≠风险的治疗方案,急性加重风险下降68%。 特发性肺纤维化急性加重的发病率与死亡率高,也是导致特发性肺纤维化患者住院和死亡的主要原因。
两项INPULSIS®试验最常见的不良事件均是轻度或中度胃肠道功能紊乱,通常可治,很少导致中止治疗。
关于特发性肺纤维化
特发性肺纤维化是一种致命性肺疾病,确诊后中位生存期为2-3年,可导致肺瘢痕进展、肺功能持续不可逆恶化和呼吸困难。特发性肺纤维化全球发病率达14-43/10万人,通常累及50岁以上人群。
这项条件性建议表示鼓励临床医生与患者讨论后再决定优选哪个治疗方案



