PROGRAF XL
Sustancias
TACROLIMUS
Forma Famacéutica y Formulación
FORMA FARMACÉUTICA Y FORMULACIÓN:
PROGRAF® XL CÁPSULAS de liberación prolongada:
Cada CÁPSULA contiene:
|
Tacrolimus monohidratado equivalente a
de Tacrolimus
|
0.5 mg
|
|
Excipiente, cbp 1 cápsula.
|
|
Tacrolimus monohidratado equivalente a
de Tacrolimus
|
1 mg
|
|
Excipiente, cbp 1 cápsula.
|
|
Tacrolimus monohidratado equivalente a
de Tacrolimus
|
5 mg
|
|
Excipiente, cbp 1 cápsula.
|
Presentación
PRESENTACIONES:
Caja con frasco con 30 ó 50 cápsulas de liberación prolongada de 0.5, 1.0 y 5.0 mg.
Caja con 30 ó 50 cápsulas de liberación prolongada de 0.5, 1.0 y 5.0 mg en envase de burbuja.
Agregar a interacciones medicamentosas
Rubros de la IPPA
INDICACIONES TERAPÉUTICAS
INDICACIONES TERAPÉUTICAS: PROGRAF® XL está indicado para la profilaxis del rechazo de órganos en pacientes que recibieron trasplantes alogénicos de riñón o hígado. Se recomienda que PROGRAF® XL sea usado concomitantemente con corticoesteroides adrenérgicos.
PROPIEDADES FARMACÉUTICAS
FARMACOCINÉTICA Y FARMACODINAMIA: PROGRAF® XL está disponible para la administración oral en forma de cápsulas (cápsulas de tacrolimus) que contienen el equivalente a 0.5 mg, 1 mg y 5 mg de tacrolimus anhidro de liberación prolongada. Los ingredientes inactivos incluyen lactosa, hidroxipropil metilcelulosa, estearato de magnesio y lactosa. El envase cápsula de 0.5 mg contiene gelatina, dióxido de titanio, y el envase cápsula de 1 mg contiene gelatina y dióxido de titanio, y el envase cápsula de 5 mg contiene gelatina, dióxido de titanio y óxido férrico.
El tacrolimus, antes conocido como FK506, es el ingrediente activo de PROGRAF® XL, el tacrolimus es un inmunosupresor macrólido producido por Streptomyces tsukubaensis.
Químicamente, el tacrolimus se llama [3S-[3/R*[E(1S*,3S*, 4S*)], 4S*,5R*,8S*,9E,12R*,14R*,15S*,16R*,18S*,19S*,26a/R*]]-5,6,8,
11,12,13,14,15,16,17,18,19,24,25,26,26a-hexadecahidro-5,19-dihidroxi-3-[2-(4-hidroxi-3-metoxiciclohexil)-1-metiletenil]- 14,16-dimetoxi-4,10,12,18-tetrametil-8-(2-propenil)-15,19-epoxi-3H-pirido[2,1-c][1,4]oxaazaciclotricosin-1,7,20,21(4H,23H)-tetrona, monohidratado.
La estructura química del tacrolimus es:
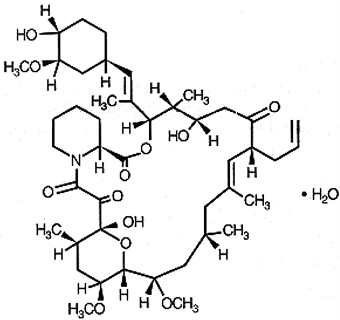
El tacrolimus tiene una fórmula empírica de C44H69 N012•H2O y un peso fórmula de 822.03. El tacrolimus se encuentra en forma de cristales blancos o polvo cristalino. Es prácticamente insoluble en agua, libremente soluble en etanol y muy soluble en metanol y cloroformo.
Tacrolimus es el ingrediente activo de PROGRAF® XL. Tacrolimus es un macrólido inmunosupresor producido por Streptomyces tsukubaensis. Se presenta en cristales blancos o polvo cristalino. Es prácticamente insoluble en agua, ligeramente soluble en etanol y muy soluble en metanol y cloroformo.
Farmacología clínica:
Mecanismo de acción: PROGRAF® XL prolonga la supervivencia del huésped y del órgano trasplantado en modelos animales receptores de trasplante de hígado, riñón, corazón, médula ósea, intestino delgado y páncreas, pulmón y tráquea, piel y córnea.
En animales, tacrolimus ha demostrado suprimir la inmunidad humoral y a un mayor grado, las reacciones mediadas por células tales como rechazo alogénico, hipersensibilidad del tipo retardada, artritis inducida por colágeno, encefalomielitis alérgica experimental y enfermedad de injerto contra huésped.
PROGRAF® XL inhibe la actividad de linfocitos T, aunque el mecanismo de acción exacto se desconoce. La evidencia experimental sugiere que el tacrolimus se une a una proteína intracelular, FKBP-12. Entonces se forma un complejo de tacrolimus-FKBP-12, calcio, calmodulina y calcineurina y se inhibe la actividad de la fosfatasa de la calcineurina. Este efecto puede prevenir la defosforilación y translocación de un factor nuclear de las células T activadas (NF-AT), un componente nuclear que se cree que inicia la transcripción de genes para la formación de linfocinas (tales como interleucina-2 e interferón gama). El resultado total es la inhibición de la activación del linfocito T. (Por ejemplo, inmunosupresión).
Farmacocinética: La actividad de PROGRAF® XL es principalmente debida al fármaco original. Los parámetros farmacocinéticos (media ± SD) del tacrolimus se han determinado después de la administración intravenosa (I.V.) y/o oral (V.O.) en voluntarios sanos, y en pacientes con trasplante de riñón, y trasplante de hígado.
Parámetros farmacocinéticos de PROGRAF® XL:
|
Población
|
N
|
Dosis
|
Día
|
Parámetros farmacocinéticos
|
|
Cmáx
(ng/ml)
|
Tmáx
(h)
|
AUC0-24§
(ng•h/ml)
|
|
Voluntarios sanos
|
24
|
4 mg
|
Día 1,
Día 10
|
6.2
11.6
|
2.0
2.0
|
74.2
155
|
|
Riñón de novo,
Adultos
|
34
|
0.19 mg/kg,
0.20 mg/kg
|
Día 1,
Día 14
|
18.2
29.9
|
3.0
2.0
|
231.0
363.9
|
|
Conversión,
Riñón adulto
|
66
|
mg
6.1 mg
|
Día 1,
Día 14
|
14.8
14.2
|
2.0
2.0
|
204.6
197.6
|
|
Hígado adulto,
De Novo
|
45
|
0.12 mg/kg
0.22 mg/kg
|
Día 1,
Día 14
|
10.6
25.7
|
4.0
2.0
|
146.0
324.2
|
|
Conversión,
Hígado adulto
|
62
|
5.2 mg
|
Día 14
|
13.3
|
2.0
|
184.0
|
|
Conversión,
Hígado pediátrico
|
18
|
5.4 mg
|
Día 7
|
15.2
|
2.0
|
193.0
|
La dosis es el promedio para el grupo, administrada una vez al día (pacientes trasplantados).
La conversión se refiere a 1:1 (mg a mg) de Prograf® a PROGRAF® XL, sobre la base de la dosis total diaria.
†: Valores promedio.
‡: Promedios aritméticos.
§: Días con tratamiento con PROGRAF* XL.
Existió una reducción marcada de la variabilidad intersujetos a la exposición (AUC0-24) en receptores de trasplante de riñón de raza negra en el estado estable posterior a la conversión de Prograf® (porcentaje de variación: %CV: 25.4%) a PROGRAF® XL (%CV: 12.2%). En receptores de trasplante renal de raza blanca, la variabilidad intrasujeto por exposición y en el estado estable fue similar posterior a la conversión de Prograf® (%CV: 12.2%) a PROGRAF® XL (%CV: 14.1%).
Debido a la variabilidad inter-sujeto en la farmacocinética de tacrolimus, la individualización del régimen de dosificación es necesaria para la terapia óptima (véase Dosis y vía de administración). Los datos farmacocinéticos indican que las concentraciones en sangre entera en lugar de las concentraciones plasmáticas sirven como el compartimiento de muestreo más adecuado para describir la farmacocinética de PROGRAF® XL.
Absorción: La absorción del tacrolimus a partir del tracto gastrointestinal después de la administración oral es incompleta y variable.
En 20 sujetos sanos, la administración oral de una suspensión acuosa de PROGRAF® XL estuvo asociada con un ABC (área bajo la curva) inferior a 5% más elevada y una Cmáx 30% más elevada comparada con la administración oral de cápsulas intactas; la administración de la suspensión acuosa vía un tubo nasogástrico se asoció con un ABC0-inf 17% más baja y una Cmáx 28% más elevada comparada con las cápsulas intactas.
Los receptores estables de trasplante de riñón e hígado pueden convertirse de una dosis de dos veces al día de PROGRAF® XL a una dosis de una vez al día de PROGRAF® XL sobre una base de dosis diaria total de 1:1 (mg: mg) para alcanzar las concentraciones apropiadas de tacrolimus en sangre (véase la siguiente tabla).
Datos biofarmacéuticos relativos (ABC0.24) en el estado continuo en receptores estables de trasplante convertidos de Prograf® a PROGRAF® XL
|
N
|
PROGRAF® XL/Prograf®
|
IC 90%
|
|
Receptores adultos de trasplante de riñón
|
66
|
95.0%
|
90.7, 99.4%
|
|
Receptores adultos de trasplante de hígado
|
62
|
88.8%
|
85.4%, 92.3%
|
|
Receptores pediátricos de trasplante de hígado
|
18
|
100.9%
|
90.8%, 112.1%
|
|
Receptores adultos de trasplante de corazón
|
59
|
92.8%
|
89.0%, 96.7%
|
IC: Intervalo de confianza. El cuadrado mínimo de la media de los parámetros se generó a partir de un ANOVA. La relación del cuadrado mínimo de la media del ABC0-24 y los intervalos de confianza al 90%, consisten en los valores naturales transformados a logaritmo (expresado como por ciento), retransformados a la escala lineal. Para todos los estudios en adultos, los datos representan una comparación de dos perfiles en el estado continuo para cada fármaco.
Hubo una fuerte correlación entre el punto más bajo (Cmín.) y la exposición (ABC0-24) después de la administración de PROGRAF® XL en los receptores de novo de trasplantes de riñón (r = 0.83) e hígado (r = 0.92), así como en la posconversión a PROGRAF® XL en riñón (r = 0.86), hígado (r = 0.90) y corazón (r = 0.94).
Efectos del alimento: La presencia de alimento afecta la absorción del tacrolimus; la velocidad y alcance de la absorción es mayor bajo condiciones de ayuno. En 24 voluntarios sanos, la administración de PROGRAF® XL inmediatamente después de un alimento alto en grasa (150 calorías de proteína, 250 calorías de carbohidratos y de 500 a 600 calorías de grasa) redujeron la Cmáx., el ABC0-t, y el ABC0-inf en aproximadamente 25% en comparación con los valores en ayunas. El alimento retardó la mediana de la Tmáx de 2 horas en el estado de ayuno a 4 horas en el estado alimentado; sin embargo, la vida media terminal permaneció en 36 horas sin importar las condiciones de administración.
En 24 voluntarios sanos, la hora de los alimentos afectó la biodisponibilidad del tacrolimus. Cuando se administró PROGRAF® XL inmediatamente después del consumo de un desayuno alto en grasas, el ABC0-inf del tacrolimus se redujo en aproximadamente 25% con relación al estado en ayuno. Cuando se administró PROGRAF® XL 1.5 horas después del consumo de un alimento alto en grasas, la exposición al tacrolimus se redujo en aproximadamente 35%. La administración de PROGRAF® XL 1 hora antes de un desayuno alto en grasas redujo la exposición al tacrolimus en 10%.
En 23 voluntarios sanos, se observó el efecto diurno sobre la absorción del tacrolimus. La administración vespertina de PROGRAF® XL redujo el ABC0-inf en 35% con relación a la administración matutina.
Distribución: La unión del tacrolimus a proteínas plasmáticas es de aproximadamente 99% y es independiente de la concentración en un rango de 5-50 ng/ml. El tacrolimus se une principalmente a albúmina y a α-1-glicoproteína ácida, y tiene un alto nivel de asociación con los eritrocitos. La distribución de tacrolimus entre la sangre completa y el plasma depende de diversos factores, como el hematócrito, la temperatura en el momento de la separación del plasma, la concentración del fármaco y la concentración de proteína plasmática. En un estudio en EUA se administró tacrolimus como Prograf®, la relación de concentración en sangre completa a concentración plasmática dio un promedio de 35 (rango de 12 a 67).
Metabolismo: El tacrolimus se metaboliza extensamente por el sistema de oxidasa de función mixta, principalmente el sistema citocromo P-450 (CYP3A). Se ha propuesto una vía metabólica que lleva a la formación de 8 posibles metabolitos. La desmetilación y la hidroxilación fueron identificados como los mecanismos primarios de biotransformación in vitro. El principal metabolito identificado en las incubaciones con microsomas hepáticos humanos es el 13-dimetil-tacrolimus. En los estudios in vitro, se ha reportado que un metabolito 31-desmetilado tiene la misma actividad que el tacrolimus.
Excreción: La depuración media después de la administración I.V. de tacrolimus es 0.040, 0.083 y 0.053 L/h/kg en voluntarios sanos, en pacientes adultos de trasplante renal y pacientes adultos de trasplante hepático, respectivamente. En el hombre, se excreta menos de 1% de la dosis administrada sin cambios en la orina.
En un estudio de balance de masas de tacrolimus radiomarcado administrado I.V. a 6 voluntarios sanos, la recuperación promedio de la radiomarca fue 77.8 ± 12.7% con la recuperación fecal explicando 92.4 ± 1.0% de la radiomarca total administrada. La vida media de eliminación basada en la radiactividad fue 48.1 ± 15.9 horas, mientras que fue de 43.5 ±11.6 horas basado en las concentraciones de tacrolimus. La depuración media de la radiomarca fue 0.029 ± 0.015 L/h/kg y la depuración media del tacrolimus fue 0.029 ± 0.009 L/h/kg. Cuando se administró por V.O. (Prograf® radiomarcado), la recuperación promedio de la radiomarca fue de 94.9 ± 30.7%. La eliminación fecal explicó el 92.6 ± 30.7% y la eliminación urinaria explicó 2.3 ± 1.1% de la radiomarca total administrada. La vida media de eliminación basada en la radiactividad fue 31.9 ± 10.5 horas, mientras que fue de 48.4 ± 12.3 horas con base en las concentraciones de tacrolimus. La depuración media de la radiomarca fue 0.226 ± 0.116 L/h/kg y la depuración media de tacrolimus fue de 0.172 ± 0.088 L/h/kg.
Poblaciones especiales:
Pediátrica: Se ha estudiado la farmacocinética del tacrolimus como Prograf® en pacientes con trasplante de hígado, de 0.7 a 13.2 años de edad. Después de la administración I.V. de una dosis de 0.037 mg/kg/día a 12 pacientes pediátricos, el promedio de la vida media terminal, el volumen de distribución y la depuración fueron de 11.5 ± 3.8 horas, 2.6 ± 2.1 L/kg y 0.138 ± 0.071 L/h/kg, respectivamente.
Con base en los datos de 18 receptores pediátricos de trasplante de hígado (5 a 13 años de edad) que fueron convertidos de Prograf® a PROGRAF® XL, los pacientes pediátricos de trasplante de hígado pueden convertirse de una dosis de dos veces diarias de Prograf® a una dosis diaria de PROGRAF® XL sobre una base de dosis total diaria de 1:1 (mg: mg) para alcanzar las concentraciones apropiadas de tacrolimus en sangre total (véase la tabla de biofarmacéutica relativa en Absorción; véase también Dosis y vía de administración).
Después de la administración de Prograf®, el punto más bajo de las concentraciones en sangre completa de 31 pacientes menores de 12 años, demostraron que los pacientes pediátricos necesitaban dosis más altas que los adultos para alcanzar concentraciones similares de tacrolimus en el punto más bajo (véase Dosis y vía de administración).
Insuficiencia renal: Se determinó la farmacocinética del tacrolimus después de una sola administración I.V. de Prograf® en 12 sujetos (7 no sometidos a diálisis y 5 con diálisis, creatinina sérica de 3.9 ± 1.6 y 12.0 ± 2.4 mg/dl, respectivamente) antes del trasplante de riñón. Los parámetros farmacocinéticos del tacrolimus fueron similares para ambos grupos.
La disposición (t½, V, Cl) del tacrolimus administrado como Prograf® en sujetos con daño renal fue similar a la observada en voluntarios sanos.
Insuficiencia hepática: La farmacocinética del tacrolimus administrado como Prograf®; fue determinada en seis sujetos con disfunción hepática leve (media de la calificación Pugh: 6.2) después de administraciones únicas I.V. y oral. La depuración media del tacrolimus en sujetos con disfunción hepática leve no fue sustancialmente diferente de la de voluntarios sanos (disfunción hepática leve: 0.042 L/h/kg I.V., 0.034 L/h/kg oral contra voluntarios sanos: 0.040 L/h/kg I.V., 0.041 L/h/kg oral).
Se estudió la farmacocinética del tacrolimus en 6 sujetos con disfunción hepática severa (media de la calificación Pugh > 10) a los que se administró Prograf®. La depuración media fue sustancialmente más baja en sujetos con disfunción hepática severa, sin importar la ruta de administración (0.017 L/h/kg I.V.; 0.016 L/h/kg oral). Se observó una prolongada vida media terminal de eliminación (I.V., oral; 60.6 ± 43.8 horas; 66.1 ± 44.8 horas, disfunción leve; 198 ± 158 y 119 ± 35 horas, disfunción severa) en sujetos con insuficiencia hepática comparados con voluntarios sanos (34.2 ± 7.7 horas, I.V.; 34.8 ± 11.4 horas, oral) que recibieron Prograf®.
Raza: Los datos de la administración de PROGRAF® XL en los pacientes de novo con trasplante de riñón indica que los pacientes de raza negra requirieron una dosis mayor para alcanzar concentraciones comparables en el punto más bajo en comparación con los pacientes de raza blanca (véase Dosis y vía de administración).
Los receptores de trasplante de riñón de raza negra (n = 12) fueron convertidos de Prograf® a PROGRAF® XL sobre una base de dosis diaria total de 1:1 (mg: mg). La relación de las medias de los mínimos cuadrados (PROGRAF® XL: Prograf®) para el ABC0-24 en el estado continuo fue de 109.8% [IC 90%: 99.0%, 121.7%] para los pacientes de raza negra. La variabilidad intrasujetos para los pacientes de raza negra se redujo con PROGRAF® XL en comparación con Prograf® (véase Farmacocinética y farmacodinamia).
Género: Los datos de receptores de trasplante de riñón, convertidos de Prograf® a PROGRAF® XL en un estudio fase 2, abierto, mostraron equivalencia en la exposición tanto para pacientes masculinos como femeninos; la relación de las medias de mínimos cuadrados (Prograf®: PROGRAF® XL) para el ABC0-24 en el estado continuo fue de 92.0% [IC 90%: 86.1, 98.3%] para las mujeres (n = 24) y 96.7% [IC 90%: 90.9, 102.9%] para los hombres (n = 42). Se encontraron resultados similares en datos de la fase 2, estudios de conversión en receptores de trasplante de hígado y corazón: en los receptores de trasplante de hígado, la relación de las medias de los mínimos cuadrados (Prograf®: PROGRAF® XL) para el ABC0-24 en el estado continuo fue 89.2% [IC 90%: 82.7, 96.1%] para mujeres (n = 26) y 88.5% [IC 90%: 84.9, 92.3%] para hombres (n = 36).
Diabetes: Los receptores estables de trasplante de riñón e hígado que tenían diabetes o un nuevo principio de diabetes después del trasplante (NO-DAT, por sus siglas en inglés) y fueron convertidos a PROGRAF® XL tuvieron relaciones de las medias de mínimos cuadrados (Prograf®: PROGRAF® XL) para el ABC0-24 de 92.0% [IC 90%: 84.8, 99.7%] en receptores de trasplante de riñón (n = 13) y 85.4% [IC 90%: 79.6, 91.5%] en receptores estables de trasplante de hígado (n = 23).
Estudios clínicos:
Receptores de novo de trasplante:
Receptores de trasplante de riñón: Se comparó la eficacia y seguridad de PROGRAF® XL + micofenolato de mofetilo (MMF) y corticosteroides (S) (n = 214) con la del Prograf® + MMF+ S (n = 212) y Neoral®† + MMF+ S (n = 212) en un estudio fase 3, sin inferioridad, aleatorizado (1:1:1), multicéntrico, abierto, comparativo, en los receptores de novo de trasplante de riñón. Se administraron los fármacos del estudio como dosis inicial oral como sigue: Prograf® 0.075-0.10 mg/kg dos veces al día; PROGRAF® XL 0.15-0.20 mg/kg una vez al día AM; Neoral 4-5 mg/kg dos veces al día. El MMF se administró de acuerdo al instructivo del empaque (CelICept®)‡. La dosis de estos inmunosupresores se ajustó con base en la evidencia clínica de eficacia, seguridad y/o concentraciones valle en sangre total. Los pacientes recibieron dos dosis I.V. de 20 mg de terapia de inducción de basiliximab. El fallo en la eficacia fue un punto final combinado que comprendía a cualquier paciente que muriera, tuviera un fallo del injerto (regreso a la diálisis > 30 días o retrasplante), tuviera una biopsia confirmada de rechazo agudo, o se perdiera para el seguimiento.
Las tasas de falla de la eficacia en 1 año fueron similares entre grupos de tratamiento (véase la tabla a continuación):
Falla de la eficacia en receptores de novo de trasplante de riñón en 1 año posterior al trasplante
|
PROGRAF® XL/
MMF
(n = 214)
|
Prograf®/
MMF
(n = 212)
|
Neoral®/
MMF
(n = 212)
|
|
Falla de eficacia
|
14.0%
|
15.1 %
|
17.0%
|
|
Diferencias de tratamiento
|
-3.0%
|
-1.9%
|
|
IC 95.2%
|
-9.9%, 4.0%
|
-8.9%, 5.2%
|
IC: Intervalo de confianza. Las diferencias de tratamiento son con relación al grupo de tratamiento con neoral (PROGRAF® XL menos neoral; Prograf® menos neoral).
Supervivencia del paciente y del injerto en receptores de novo de trasplante de riñón en 1 año posterior al trasplante
|
PROGRAF® XL/
MMF
(n = 214)
|
Prograf®/
MMF
(n = 212)
|
Neoral®/
MMF
(n = 212)
|
|
Supervivencia del paciente
|
98.6 %
|
95.7%
|
97.6%
|
|
Estimado de la diferencia Kaplan-Meier
|
1.0%
|
-1.9%
|
|
IC 95%
|
-1.6%, 3.6%
|
-5.3%, 1.5%
|
|
Supervivencia del injerto
|
96.7%
|
02.9%
|
95.7%
|
|
Estimado de la diferencia Kaplan-Meier
|
1.0%
|
-2.9%
|
|
IC 95%
|
-2.7%, 4.6%
|
-7.3%, 1.6%
|
IC: Intervalo de confianza. El estimado de la diferencia de Kaplan-Meier es con relación al grupo de tratamiento con neoral (PROGRAF® XL menos Neoral; Prograf menos neoral). Datos obtenidos en el momento del último seguimiento.
Función renal en receptores de novo de trasplante de riñón a los 6 y 12 meses posteriores al trasplante
|
PROGRAF® XL/
MMF
(n = 214)
|
Prograf®/
MMF
(n = 212)
|
Neoral®/
MMF
(n = 212)
|
Valores de p
|
|
PROGRAF® XL vs. Neoral®
|
Prograf® vs. Neoral®
|
|
Niveles medios de creatinina sérica (mg/dl)
|
|
6 meses
|
1.46 ± 0.55
|
1.42 ± 0.43
|
1.51 ± 0.50
|
0.238
|
0.015
|
|
12 meses
|
1.39 ± 0.44
|
1.42 ± 0.56
|
1.48 ± 0.51
|
0.047
|
0.057
|
|
Niveles medios de creatinina sérica (mg/dl)
|
|
6 meses
|
56.7 ± 18.24
|
56.8 ± 17.25
|
53.6 ± 15.92
|
0.036
|
0.015
|
|
12 meses
|
58.7 ± 18.26
|
57.7 ± 18.81
|
54.6 ± 17.60
|
0.008
|
0.013
|
Datos adicionales de eficacia en receptores de novo de trasplante de riñón en 1 año
|
|
PROGRAF® XL/
MMF
(n = 214)
|
Prograf®/
MMF
(n = 212)
|
Neoral®/
MMF
(n = 212)
|
Valores de p
|
|
PROGRAF® XL vs. Neoral®
|
Prograf® vs. Neoral®
|
|
Falla del tratamiento
|
14.5%
|
15.6%
|
28.8%
|
< 0.001
|
0.001
|
|
Cambio debido a falla del tratamiento
|
4.7%
|
2.8%
|
18.4%
|
< 0.001
|
< 0.001
|
|
Retiros de pacientes
|
|
Eventos adversos
|
8.9%
|
10.8%
|
17.5%
|
0.010
|
0.069
|
|
Incumplimiento
|
0.9%
|
1.9%
|
2.4%
|
0.283
|
1.000
|
|
Rechazo |
|



